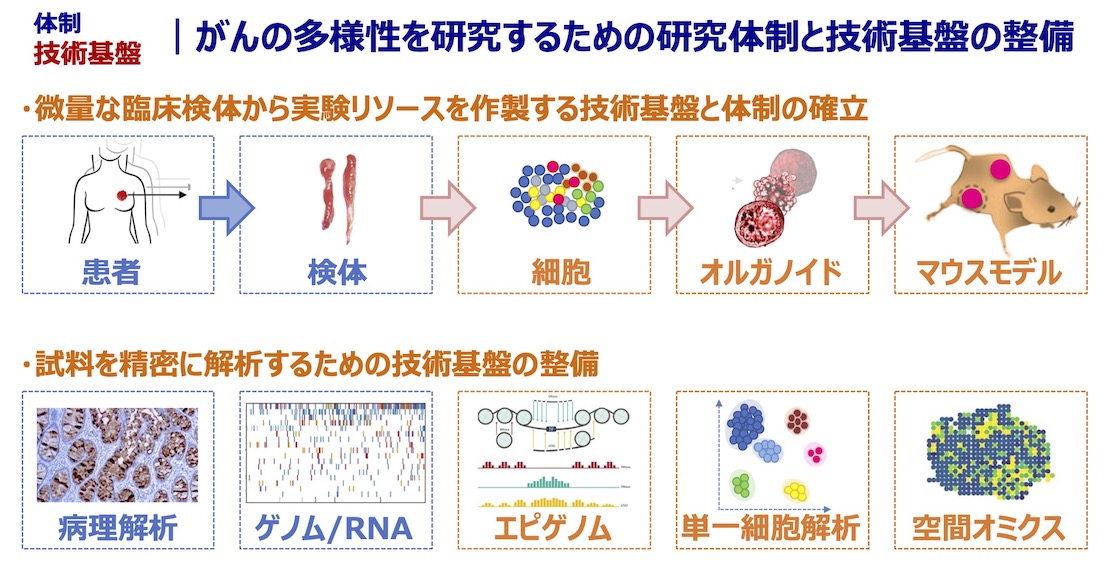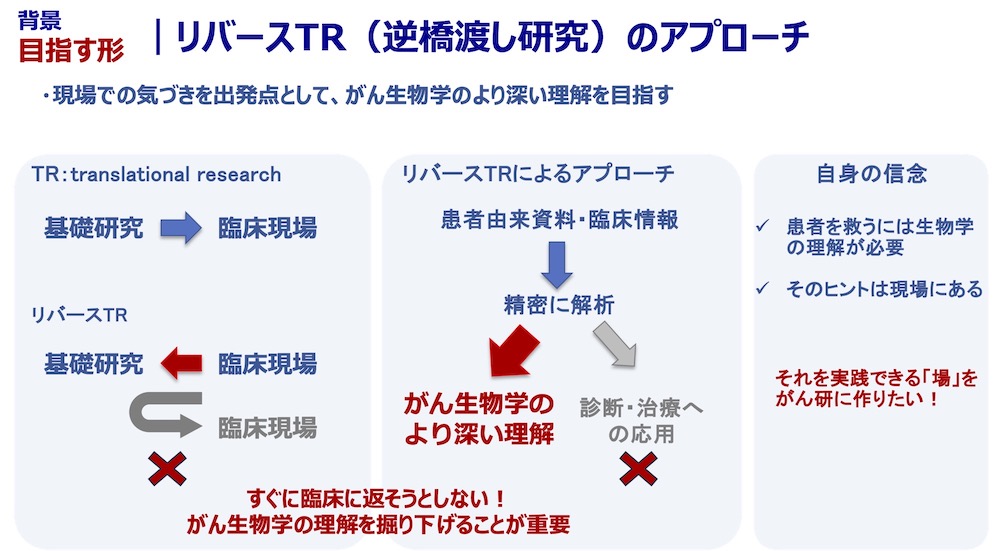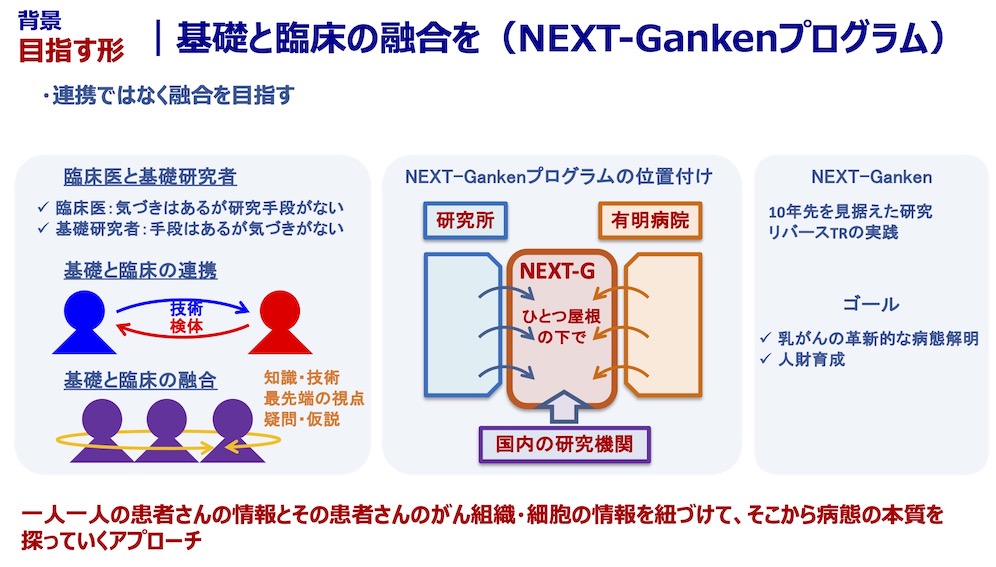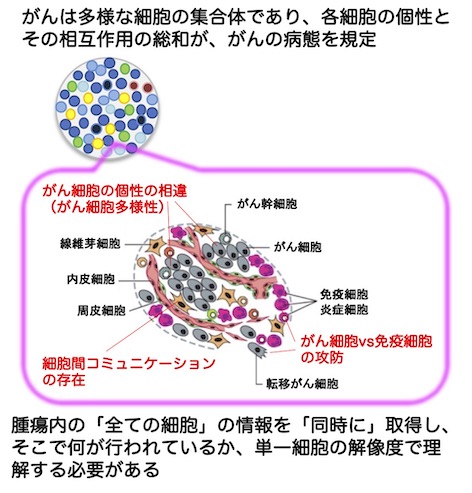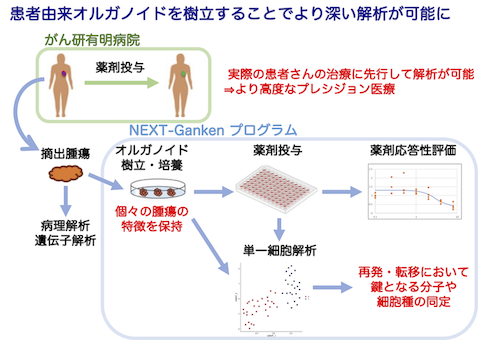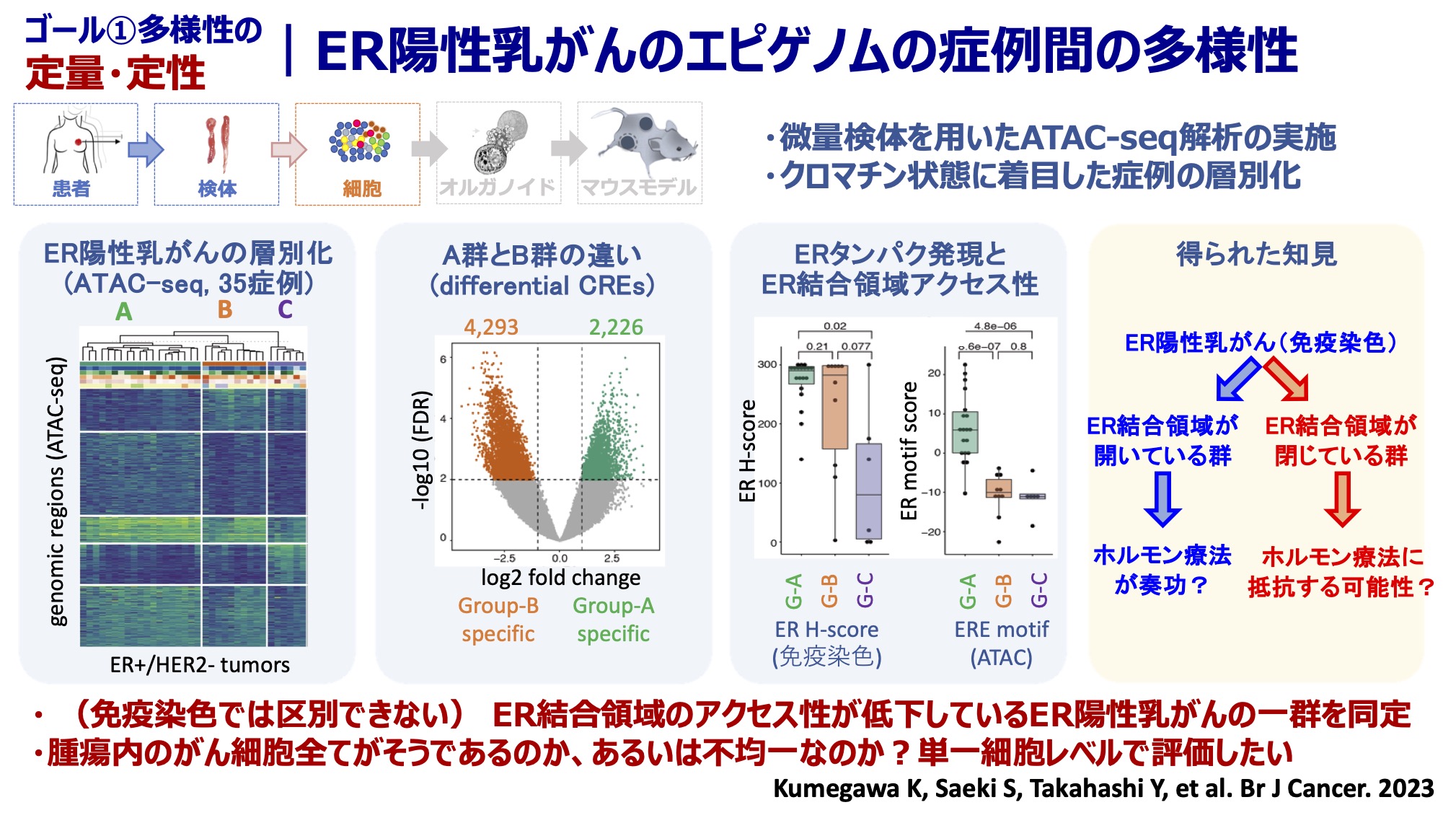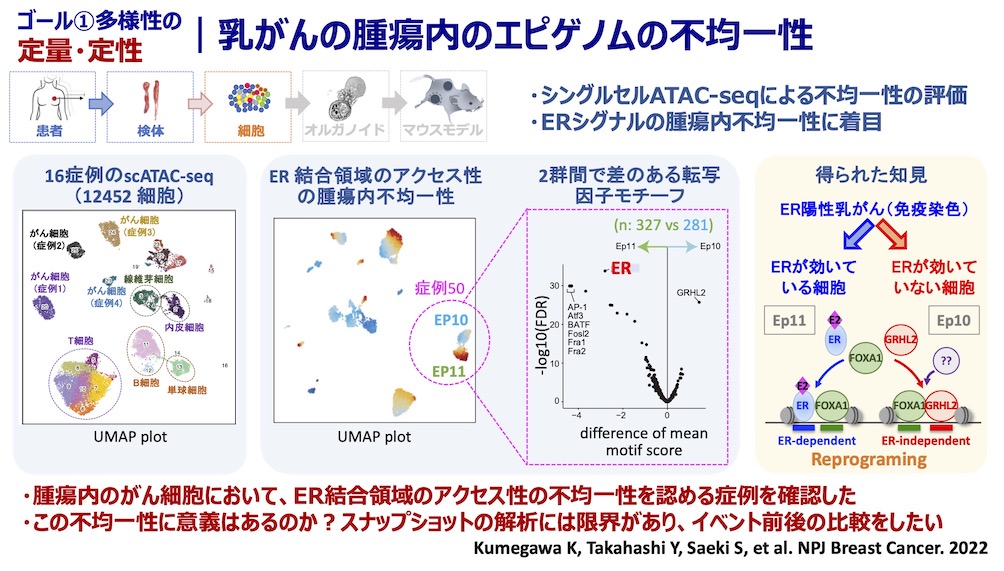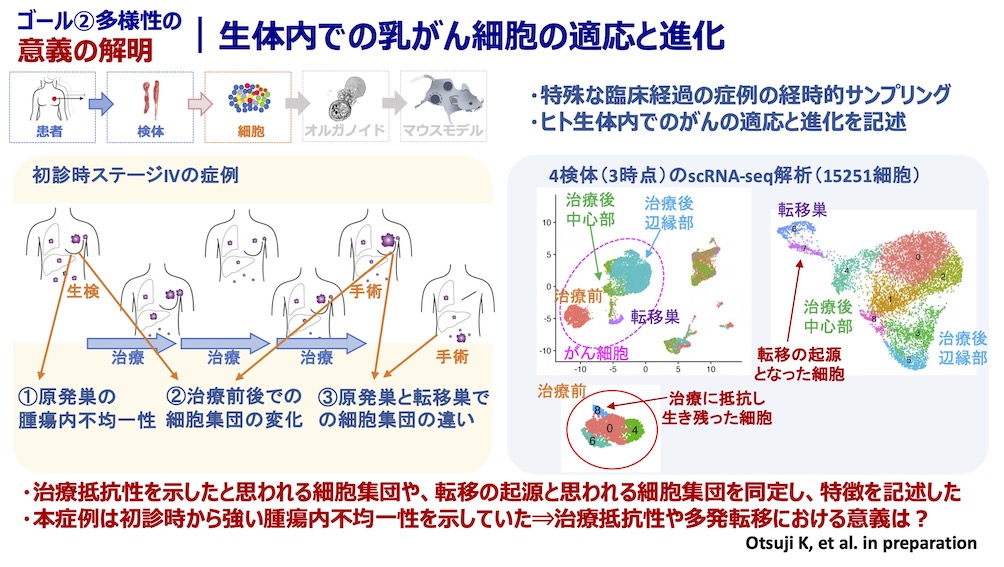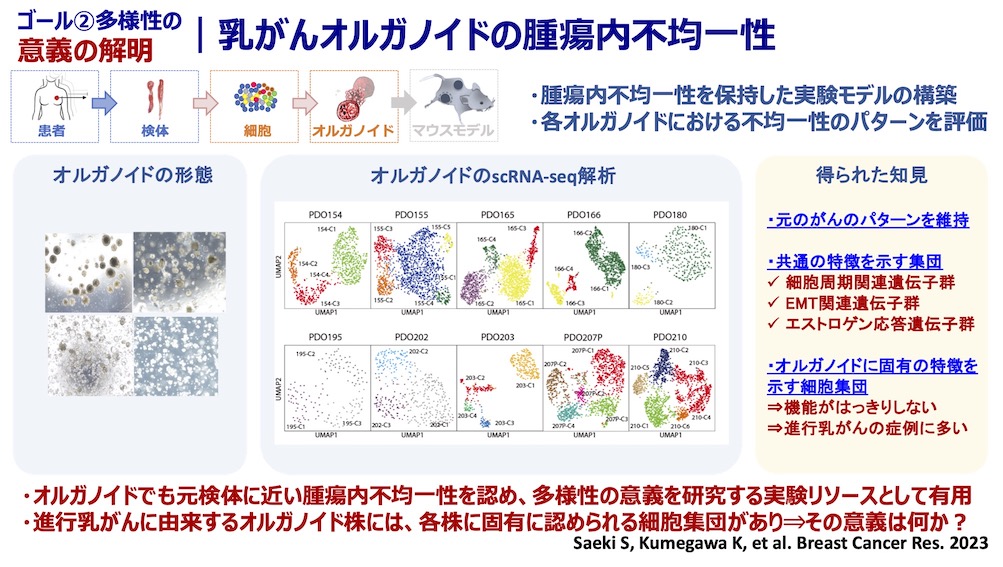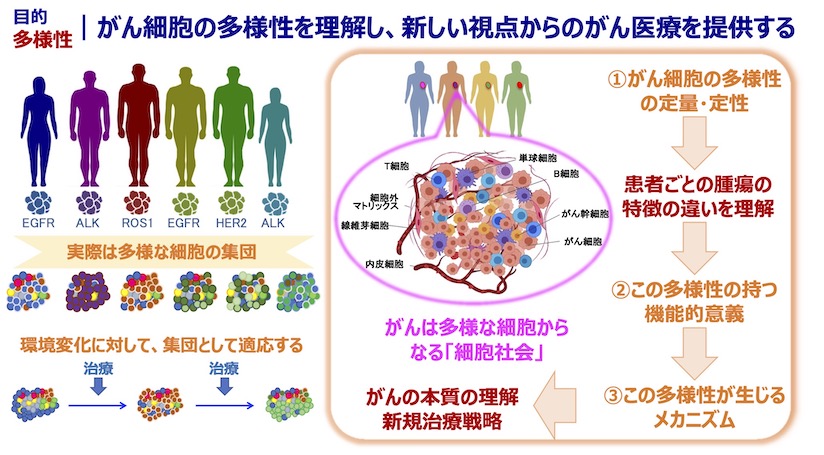
私たちの研究室では「がん細胞の多様性を理解し、新しい視点からのがん医療を提供する」ことを目標に掲げ研究を行っています。がんは均一なクローンの細胞集団ではなく、実際は多様な細胞から構成されており、治療などの外部の環境変化に対して、細胞集団全体で適応する能力を持っています。この多様性と適応能力が、がんの治療を難しくさせている一因です。私たちはがんに含まれるがん細胞の多様性を正確に評価することで、患者ごとの腫瘍の特徴の違いを理解することを目指しています。さらに、がん細胞が多様であることの機能的意義や、その多様性が生じるメカニズムを明らかにしたいと考えています。この多様性こそががんの本質であり、その理解が全く新しい治療戦略を生み出すカギになると考えています。